Термодинамическая температура
Содержание:
- Шкала Кельвина
- Температура с термодинамической точки зрения
- Температура — кельвин
- Распределение энергии по степеням свободы
- Измерения по Фаренгейту
- Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Кельвин, градус Цельсия — единицы измерения температуры в системе СИ
- Фаренгейт, Цельсий и Кельвин
- Шкала — абсолютная температура
- Зависимость объема от абсолютной температуры
- Сравнение температурных шкал
- Единицы и шкала измерения температуры
- Температура и нулевое начало термодинамики
- Абсолютная температурная шкала. Абсолютный нуль
- Макроскопические и микроскопические тела.
Шкала Кельвина
Английский ученый У. Кельвин ввел абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, и единица температуры по этой шкале равна градусу по шкале Цельсия, поэтому абсолютная температура Т связана с температурой по шкале Цельсия формулой
Т = t + 273. (3.7.6)
На рисунке 3.11 для сравнения изображены абсолютная шкала и шкала Цельсия.
Единица абсолютной температуры в СИ называется кельвином (сокращенно К). Следовательно, один градус по шкале Цельсия равен одному градусу по шкале Кельвина: 1 °С = 1 К.
Таким образом, абсолютная температура по определению, даваемому формулой (3.7.6), является производной величиной, зависящей от температуры Цельсия и от экспериментально определяемого значения α. Однако она имеет фундаментальное значение.
С точки зрения молекулярно-кинетической теории абсолютная температура связана со средней кинетической энергией хаотического движения атомов или молекул. При Т = 0 К тепловое движение молекул прекращается. Подробнее об этом пойдет речь в главе 4.
Температура с термодинамической точки зрения
Введем функцию
, которая не зависит от свойств вещества. Из термодинамики следует, что если какая-то тепловая машина, поглощая количество теплоты
при
выделяет тепло
при
, выделяет то же самое тепло
при температуре в один градус, то машина, поглощающая
при
должна при температуре
выделять тепло
. Конечно, между теплом
и температурой
существует зависимость и тепло
должно быть пропорционально
. Таким образом, каждому количеству тепла
, выделенного при температуре в один градус, соответствует количество тепла, поглощённого машиной при температуре
, равное
, умноженному на некоторую возрастающую функцию
температуры:
Поскольку найденная функция возрастает с температурой, то можно считать, что она сама по себе измеряет температуру, начиная со стандартной температуры в один градус. Это означает, что можно найти температуру тела, определив количество тепла, которое поглощается тепловой машиной, работающей в интервале между температурой тела и температурой в один градус. Полученная таким образом температура называется абсолютной термодинамической температурой и не зависит от свойств вещества. Таким образом, для обратимой тепловой машины выполняется равенство:
где
— энтропия:
Для системы, в которой энтропия
может быть функцией
её энергии
, термодинамическая температура определяется как:
Температура и излучение
При повышении температуры растёт энергия, излучаемая нагретым телом. Энергия излучения абсолютно чёрного тела описывается законом Стефана — Больцмана
Шкала Реомюра
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)
1 °R = 1,25° C.
Температура — кельвин
Температура Цельсия ( символ t) определяется выражением: t Т — Т0, Т — температура Кельвина, Т0 273 15 К.
Допускается применять также градус Цельсия С, по размеру равный Кельвину, для выражения температуры Цельсия tT — Te, где Т — температура Кельвина, 7о273 15 К. Тройная точка воды — состояние, при котором находятся в равновесии все г три ее фазы: лед, жидкая вода и насыщенный пар. Равновесие трех фаз воды достигается лишь при вполне определенной тем — пературе 273 16 К0 01 С, в отличие от равновесия каких-либо двух ее фаз, которое возможно и при разных температурах.
Кроме температуры Кельвина, К ( обозначение 7) допускается применение температуры Цельсия, С ( обозначение t), определяемой выражением t — Т-27315 К. Температура Кельвина выражается в кель-винах ( градусах Кельвина), температура Цельсия — в градусах Цельсия. Числовое значение температуры должно сопровождаться значками К и С. По величине кельвин и градус Цельсия равны между собой. Различие состоит лишь в начале отсчета ( см. гл.
Переход от значений температуры в шкале Цельсия к значениям в шкале Кельвина рассматривается в гл. В системе СИ при использовании шкалы температур Кельвина знак градуса не указывается.
Температура таяния льда при нормальном давлении обозначена 0 С. Как видим, разница между абсолютной шкалой температур Кельвина и шкалой Цельсия только в начале отсчета ( в положении нуля) температуры.
Температура Цельсия определяется выражением tT — Тй, где Т — температура Кельвина, Г 273 15 К.
Параметры тройной точки воды следующие: давление насыщенного пара — 4 58 мм рт. ст. 0 006 атм, температура О 01 С. Тройная точка воды является реперной точкой при построении абсолютной термодинамической шкалы температур Кельвина.
Практически для термометрии нет необходимости осуществлять цикл Карно, в котором экспериментальные ошибки обычно очень велики. Температура, введенная во втором законе термодинамики как интегрирующий делитель, как раз и есть температура Кельвина.
В практической термометрии нет необходимости осуществлять циклы Карно, экспериментальные ошибки при проведении которых часто были бы недопустимо велики. Во втором законе термодинамики температура вводится как величина, обратная интегрирующему множителю; можно показать, что температура, определенная таким образом, совпадает с температурой Кельвина.
В практической термометрии нет необходимости осуществлять циклы Карно, экспериментальные ошибки при проведении которых часто были бы недопустимо велики. Во втором законе термодинамики температура водится как величина, обратная интегрирующему множителю; можно показать, что температура, определенная таким образом, совпадает с температурой Кельвина.
Уравнение ( 12) было получено из термодинамического тождества ( 5) и на основе двух изотермических законов поведения идеального газа, а также эмпирического определения величины моля. Величина Т, входящая в уравнение ( 12), та же что и в термодинамическом тождестве ( 5), и, следовательно, является температурой Кельвина.
Однако всякий газ, который строго подчиняется закону Бойля — Мариотта и у которого изменение объема при постоянной температуре не меняет внутренней энергии и, подчиняется закону pv kT, где Т представляет температуру Кельвина. Такой газ, называемый идеальным газом, будучи использован в газовом термометре постоянного давления или постоянного объема, непосредственно воспроизводит шкалу Кельвина.
Кроме температуры Кельвина ( обозначение Т) допускается применять также температуру Цельсия ( обозначение t), определяемую выражением t T — Т, где Г 273 15К по определению. По размеру градус Цельсия равен кельвину. Разность температур Кельвина выражается в Кельвинах. Разность температур Цельсия допускается выражать как в Кельвинах, так и в градусах Цельсия.
Кроме температуры Кельвина ( обозначение Т) допускается применять также температуру Цельсия ( обозначение t), определяемую выражением t T — Tn, где Т0 273 15К по определению. По размеру градус Цельсия равен кельвину. Разность температур Кельвина выражается в Кельвинах. Разность температур Цельсия допускается выражать как в Кельвинах, так и в градусах Цельсия.
По размеру градус Цельсия равен кельвину. Интервал или разность температур Кельвина выражают в Кельвинах. Интервал или разность температур Цельсия допускается выражать как в Кельвинах, так и в градусах Цельсия.
Распределение энергии по степеням свободы
Выражение
для средней энергии молекулы газаучитывает только её среднюю энергию
поступательного движения. Но наряду с
поступательным движением, молекула
может вращаться и совершать колебания.
Эти виды движения так же связаны с
некоторым запасом энергии, определить
который, можно пользуясь понятием
статистической физики о равном
распределении энергии по степеням
свободы.
Число
независимых координат, необходимых для
полного описания положения системы в
пространстве, называется
числом степеней свободы
(i).
Так,
например, движение точки, совершающей
перемещение по всей области пространства
в любой момент времени будет полностью
описано тремя координатами, т. е. она
обладает тремя степенями свободы (i=3).
Если на характер
изучаемого движения накладывать
некоторые ограничения, то число степеней
свободы уменьшается.
Так
для описания движения точки по поверхности
необходимо задать две независимые
координаты, т.е. движущаяся по поверхности
точка имеет две степени свободы (i
= 2).
Точка,
совершающая движение по прямой, имеет
одну степень свободы (i
= 1). В общем
случае точка или система точек наряду
с поступательным движением может
одновременно участвовать во вращательном
и колебательном движениях. Общее число
степеней свободы в этом случае будет
равно
(12.1)
где
iп
— число степеней свободы поступательного
движения точки;
iвр
— число степеней свободы вращательного
движения точки;
iк
— число степеней свободы колебательного
движения точки ();
iкп
— число степеней свободы колебаний точки
при поступательном движении;
iквр
— число степеней свободы колебаний точки
при вращательном движении.
По аналогии с механическими системами,
каждой молекуле, каждому атому газа
можно приписать определённое число
степеней свободы, рассматривая при этом
их как материальные точки. Так, одноатомная
молекула газа имеет только три степени
свободы поступательного движения (i= 3); двухатомная при упругой связи –
шесть степеней свободы (i= 6), а при жёсткой связи — пять степеней
свободы (i= 5);
трёхатомная молекула при жёсткой связи
между атомами имеет шесть степеней
свободы (i= 6).
Известно,
что средняя кинетическая энергия
поступательного движения молекул равна
Поступательное
движение описывается тремя степенями
свободы, а т.к. все степени свободы
равноправны, то на каждую из них приходится
(12.2)
Но
ни один из видов движения (поступательное,
вращательное, колебательное) не имеет
преимуществ перед другими. Следовательно,
можно утверждать: «На любую степень
свободы приходится в среднем одинаковая
энергия, а молекула, обладающая i степенями
свободы, будет обладать энергией».
Данное утверждение называюттеоремой
о равномерном распределении энергии
по степеням свободы
(теорема Больцмана).
Измерения по Фаренгейту
Конвертацию значений из Фаренгейта в градусы Цельсия можно осуществить по несложным правилам, учитывая тот факт, что точка замерзания по Цельсию на 32 единицы ниже, чем по Фаренгейту.
Пример:
- 1°F = (1–32) * 0,55555 = — 17 °C;
- 10°F = (10–32) * 0,55555 = — 12 °C;
- 32°F = (32–32) * 0,55555 = 0 °C;
- 50°F = (50–32) * 0,55555 = +10 °C;
- и т. д.
Однако, при обратной конвертации из Цельсия в Фаренгейты, расчёты по приведённой системе будут неточными, поэтому лучше прибегнуть к разработанной Фаренгейтом таблице. А также можно воспользоваться онлайн-калькулятором, размещённым на любом тематическом сайте. Показатели принятой таблицы перевода величин и расчётные данные по онлайн-калькулятору выглядят так:
- 0С = 32 F;
- 1С = 33,8F;
- 10С = 50F;
- 100С = 212F.
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Подробности
- Просмотров: 581
Температура — это просто!
Температура
Температура — это мера средней кинетической энергии молекул.
Температура характеризует степень нагретости тел.
Прибор для измерения температуры — термометр.Принцип действия термометра:
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры.
В жидкостных термометрах — это изменение объема жидкости.
При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой.
В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
Жидкостные термометры
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35oС до +750oС) и спиртовые (от -80oС до +70oС).
В них используется свойство жидкости изменять свой объем при изменении температуры.
Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах.
В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
Этих недостатков лишены газовые термометры.
Газовые термометры
Первый газовый термометр был создан французским физиком Ж. Шарлем.
Преимущества газового термометра:
— используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов
— точность измерения от 0,003oС до 0,02oС
— интервал температур от -271oС до +1027oС.
Тепловое равновесие
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются.
Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях. Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго.
Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k — постоянная Больцмана
Эта зависимость дает возможность ввести новую температурную шкалу абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
Абсолютная шкала температур
— введена английским физиком У. Кельвином
— нет отрицательных температур
Единица абсолютной температуры в СИ: = 1K (Кельвин)
Нулевая температура абсолютной шкалы — это абсолютный ноль ( 0К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура — 0,0001К.
По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия
Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
После введения абсолютной температуры получаем новые выражения для формул:
Средняя кинетическая энергия поступательного движения молекул
Давление газа — основное уравнение МКТ
Средняя квадратичная скорость молекул
И как следствие, закон Авогадро:
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.Заметьте, здесь концентрация молекул также одинакова!
Следующая страница «Идеальный газ. Основное уравнение МКТ»
Назад в раздел «10-11 класс»
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Кельвин, градус Цельсия — единицы измерения температуры в системе СИ
В Международной системе единиц (СИ), единицей термодинамической температуры ($T$) является кельвин (К). Это основная единица данной системы единиц. Один кельвин — это термодинамическая температура равная $\frac{1}{273,16}$ части от температуры тройной точки воды. К недостатками такого определения относят то, что попытки получить температуру в один кельвин связаны с зависимостью от чистоты и изотопного состава воды. Существуют попытки дать определение одного кельвина через величину постоянной Больцмана ($k=1,38\cdot {10}^{-23}\frac{Дж}{К}$). Вероятно в таком случае один кельвин — это будет такое изменение температуры, которое ведет к изменению энергии (на одну степень свободы) равному $kT$=$1,38\cdot {10}^{-23}Дж$.
Единица термодинамической температуры именована в честь английского ученого У. Томсона (лорда Кельвина). Вплоть до 1968 г. единицу термодинамической температуры называли градусом Кельвина. Начало шкалы термодинамической температуры совпадает с абсолютным нулем ($T=0К$).
Кратные и дольные единицы кельвина получают используя стандартные приставки системы СИ, например, кК — килокельвин ($1кК={10}^3К$); пК -пикокельвин ($1пК={10}^{-12}К$) и т.д.
Градус Цельсия (${\rm{}^\circ\!C}$) — это еще одна единица измерения температуры ($t$), которую используют в системе СИ совместно с кельвином. Свое название ${\rm{}^\circ\!C}$ получил в честь шведского ученого А. Цельсия, который создал свою шкалу измерения температуры. На сегодняшний момент градус Цельсия равен кельвину, однако ноль шкалы температур по Цельсию сдвинут относительно шкалы Кельвина:
Фаренгейт, Цельсий и Кельвин
Немец Габриэль Фаренгейт предложил свою шкалу зимой 1709 года.
За ноль он принял точку, до которой опустилась ртуть в его термометре в один очень холодный зимний день в Данциге (ныне польский Гданьск). Чтобы вы имели представление, что называлось для тех мест очень холодно, это около 18 градусов мороза по Цельсию. В качестве другой отправной точки он выбрал самую распространенную и относительно постоянную температуру – температуру человеческого тела.
По этой схеме вода замерзала при +32, а кипела при +212. Все это, конечно, при давлении на нулевой отметке по высоте, то есть на уровне моря, где собственно и был расположен Данциг – знаменитый морской порт.
Шкалой Фаренгейта привыкли пользоваться в теплых странах, где нет больших перепадов температуры, и термометры не показывают отрицательных значений. Прилетев в США и увидев, что там +50, не пугайтесь. Это по Фаренгейту, а по-нашему, по Цельсию, это всего +10.
И чтобы быстренько пересчитать, отнимите 32 от непонятной температуры и оставшееся разделите на 1,8.
Через 33 года после Фаренгейта, шведский астроном Андерс Цельсий предложил свою шкалу.
В 1742 году Цельсий за ноль взял температуру смеси воды и льда, а за 100 градусов – температуру кипения воды.
Таким образом, за один градус принимается сотая часть интервала между двумя крайними точками: замерзанием и кипением воды. Эта шкала, конечно, более привычная для нас, чем непонятная шкала Фаренгейта. И чтобы американцы, приезжая в гости в другую страну, понимали, где тепло, а где холодно, им надо произвести несложные вычисления: умножить непонятную им температуру на 2 и прибавить еще 30. И тогда они получат им понятные градусы Фаренгейта. Впрочем, они могут воспользоваться и другим способом подсчета. Поймав сверчка, подсчитав сколько раз он прострекочет за 14 секунд и прибавив 40, можно узнать пресловутые градусы Фаренгейта.
Абсолютная температурная шкала Кельвина нашла широкое применение в науке.
Она была предложена английским ученым Уильямом Томсоном (он же лорд Кельвин), для наиболее точного способа измерения температуры во всех мыслимых ситуациях. По этой шкале нулевая точка, или абсолютный ноль, — самая низкая температура, какая только возможна. Это некое теоретическое состояние вещества, при котором его молекулы полностью перестают двигаться. Для понимания скажу, что это –273 градуса Цельсия. А значит наш ноль равен +273 градуса Кельвина. А вот температура, которая возникает при атомных взрывах, самая высокая, получаемая на Земле, составляет более миллиона градусов Кельвина. И эта шкала в основном применяется в научных целях. В отличие от шкалы Реомюра, которая была предложена еще до Цельсия, в 1731 году, французом Рене де Реомюром. Она использовала свойство спирта расширяться. Но за нижнюю точку было принято замерзание воды.
Шкала — абсолютная температура
Шкала абсолютных температур ( К) имеет только положительные отсчеты от абсолютного нуля — той температуры, ниже которой невозможно дальнейшее охлаждение физического тела. Измерение температур по этой шкале не зависит от физических свойств веществ, Применяемых для термометров.
Шкала абсолютных температур ( К) имеет только положительные отсчеты от абсолютного нуля — той температуры, ниже которой невозможно дальнейшее охлаждение физического тела. Измерение температур по этой шкале не зависит от физических свойств веществ, применяемых для термометров.
Шкалу абсолютных температур, у которой нижняя граница тем-ратурного промежутка определяется состоянием абсолютного коя молекул, называют термодинамической шкалой Кельвина.
В шкале абсолютных температур, имеющей широкое применение в термодинамике, расстояние между постоянными точками, как и в стоградусной шкале, разделено на 100 частей, нуль же шкалы перенесен на 273 деления ниже точки плавления льда.
Кельвина или по шкале абсолютных температур.
Если температуру выразить в шкале абсолютных температур ( градусы Кельвина), то логарифмическая зависимость получается почти прямолинейной.
Температуру Т отсчитывают по шкале абсолютных температур ( шкала Кельвина) от такого значения, принятого за нуль, по мере приближения к которому энергия хаотического теплового движения молекул также стремится к нулю. При этом сильно проявляются различные квантовые эффекты. При температуре, приближающейся к абсолютному нулю, наблюдается быстрое спадение теплоемкости, у ряда металлов-проявляется сверхпроводимость, жидкий гелий делается сверхтекучим.
Наряду со стоградусной шкалой применяется также шкала абсолютных температур, нуль которой лежит на 273 15 ( округленно 273) ниже температуры точки плавления льда. Температура, измеряемая по этой шкале, называется абсолютной, или температурой в градусах Кельвина. В обеих шкалах единица измерения ( градус) остается одной и той же.
Наряду со стоградусной шкалой применяется также шкала абсолютных температур, ноль которой лежит на 273 ( округлено) ниже температуры точки плавления льда. Температура, измеряемая по этой шкале, называется абсолютной, или температурой в градусах Кельвина. В обеих шкалах единица измерения ( градус) остается одной и той же.
|
Схема открытой системы. |
Какое выражение является исходным для построения шкалы абсолютной температуры.
От абсолютною нуля начинается отсчет по шкале абсолютных температур, часто применяемой при научных и технических исследованиях. Градус ( СК) ее имеет такую же величину, как и градус обычной стоградусной шкалы ( СС), Нуль последней будет, следовательно, равняться 273 по абсолютной шкале.
От абсолютного пуля начинается отсчет по шкале абсолютных температур, часто применяемой при научных и технических исследованиях. Абсолютная шкала очень удобна, так как не содержит отрицательных температур.
От абсолютного нуля начинается отсчет по шкале абсолютных температур, часто применяемой при научных и технических исследованиях. Абсолютная шкала очень удобна, так как не содержит отрицательных температур.
Земные условия относятся к чрезвычайно холодному участку шкалы абсолютных температур, и химические превращения, в совокупности составляющие метаболизм, просто не могли бы происходить с достаточной для поддержания жизни скоростью, если бы не было биологических катализаторов, природу которых мы сейчас кратко рассмотрим.
Зависимость объема от абсолютной температуры
Применяя шкалу Кельвина, закон Гей-Люссака (3.6.4) можно записать в более простой форме. Так как
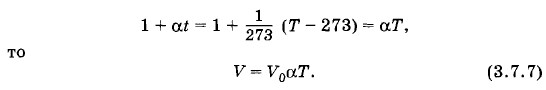
Объем газа данной массы при постоянном давлении прямо пропорционален абсолютной температуре.
Отсюда следует, что отношение объемов газа одной и той же массы в различных состояниях при одном и том же давлении равно отношению абсолютных температур:

|
Существует минимально возможная температура, при которой объем (и давление) идеального газа обращаются в нуль. Это абсолютный нуль температуры. -273 °С. Удобно отсчитывать температуру от абсолютного нуля. Так строится абсолютная шкала температур. |
Сравнение температурных шкал
| Описание | ||||||||
|---|---|---|---|---|---|---|---|---|
| −273.15 | −459.67 | 559.725 | −90.14 | −218.52 | −135.90 | |||
| 255.37 | −17.78 | 459.67 | 176.67 | −5.87 | −14.22 | −1.83 | ||
| Температура замерзания воды (Нормальные условия) | 273.15 | 32 | 491.67 | 150 | 7.5 | |||
| Средняя температура человеческого тела ¹ | 310.0 | 36.6 | 98.2 | 557.9 | 94.5 | 12.21 | 29.6 | 26.925 |
| Температура кипения воды (Нормальные условия) | 373.15 | 100 | 212 | 671.67 | 33 | 80 | 60 | |
| Плавление титана | 1941 | 1668 | 3034 | 3494 | −2352 | 550 | 1334 | 883 |
| Поверхность Солнца | 5800 | 5526 | 9980 | 10440 | −8140 | 1823 | 4421 | 2909 |
¹
Нормальная средняя температура человеческого тела — 36.6 ° C ±0.7 ° C, или 98.2 °F ±1.3 °F. Приводимое обычно значение 98.6 °F — это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения 37 ° C. Однако это значение не входит в диапазон нормальной средней температуры тела человека, поскольку температура разных частей тела разная.
Единицы и шкала измерения температуры
Шкала температур Кельвина
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что приблизительно равно −273.15 °C.
Температуре замерзания воды при стандартном атмосферном давлении соответствуют 273,15 K. Число градусов Цельсия и кельвинов между точками замерзания и кипения воды одинаково и равно 100. Поэтому градусы Цельсия переводятся в кельвины по формуле K = °C + 273,15.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), 1 °F = 9/5 °С + 32. Предложена Г. Фаренгейтом в 1724.
Температура и нулевое начало термодинамики
Я говорил в самом начале, что гиря и плюшевый медведь, находясь длительное время в комнате будут иметь примерно одинаковую температуру.
В основе этого утверждения лежит фундаментальный постулат или нулевое начало термодинамики, которое фактически дает определение температуры.
В каком бы состоянии не находились тела в изолированной термодинамической системе, со временем эта система придет в состояние теплового (термодинамического) равновесия, и все части этой системы будут иметь одинаковую температуру.
Конечно, комната не совсем изолированная термодинамическая система. Но в физике главное что? Правильно! Умение пренебрегать.
Пока тела имеют разную температуру между ними может происходить теплообмен. Горячие тела будут остывать, холодные нагреваться. Но как только температура тел сравняется, теплообмен между ними прекратится.
По этому поводу Рудольф Клаузиус в 1865 году выдвинул даже гипотезу о тепловой смерти вселенной. Согласно этой гипотезе вселенная рано или поздно должна прийти к термодинамическому равновесию и умереть.
Но вернемся к температуре. Мы разобрались что фактически температура является величиной, характеризующей способность тел или термодинамических систем вступать в тепловое взаимодействие друг с другом. Давайте теперь подумаем, как можно ее измерять, не прибегая к помощи пальца.
Абсолютная температурная шкала. Абсолютный нуль
Выбор в качестве основных точек температурной шкалы точек таяния льда и кипения воды совершенно произволен. Полученная таким образом температурная шкала оказалась неудобной для теоретических исследований.
Опираясь на законы термодинамики, Кельвину удалось построить так называемую абсолютную температурную шкалу (ее в настоящее время называют термодинамической шкалой температур или шкалой Кельвина), совершенно не зависящую ни от природы термометрического тела, ни от избранного термометрического параметра. Однако принцип построения такой шкалы выходит за пределы школьной программы.
Мы рассмотрим этот вопрос, используя другие соображения.
Из формулы (2) вытекают два возможных способа установления температурной шкалы: использование изменения давления определенного количества газа при постоянном объеме или изменение объема при постоянном давлении. Такую шкалу называют идеальной газовой шкалой температуры.
Температура, определяемая равенством (2), называется абсолютной температурой. Абсолютная температура Τ не может быть отрицательной, так как слева в равенстве (2) стоят заведомо положительные величины (точнее, она не может быть разных знаков, она может быть либо положительной, либо отрицательной. Это зависит от выбора знака постоянной k. Так как условились температуру тройной точки считать положительной, то абсолютная температура может быть только положительной). Следовательно, наименьшее возможное значение температуры Т = 0 есть температура, когда давление или объем равны нулю.
Предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю (т.е. газ как бы должен сжаться в «точку») при неизменном давлении, называется абсолютным нулем. Это самая низкая температура в природе.
Из равенства (3), учитывая, что \(~\mathcal h W_K \mathcal i = \frac{m_0 \mathcal h \upsilon^2 \mathcal i}{2}\) , вытекает физический смысл абсолютного нуля: абсолютный нуль — температура, при которой должно прекратиться тепловое поступательное движение молекул. Абсолютный нуль недостижим.
В Международной системе единиц (СИ) используют абсолютную термодинамическую шкалу температур. За нулевую температуру по этой шкале принят абсолютный нуль. В качестве второй опорной точки принята температура, при которой находятся в динамическом равновесии вода, лед и насыщенный пар, так называемая тройная точка (по шкале Цельсия температура тройной точки равна 0,01 °С). Каждая единица абсолютной температуры, называемая Кельвином (обозначается 1 К), равна градусу Цельсия.
Погружая колбу газового термометра в тающий лед, а затем в кипящую воду при нормальном атмосферном давлении, обнаружили, что давление газа во втором случае в 1,3661 раза больше, чем в первом. Учитывая это и пользуясь формулой (2), можно определить, что температура таяния льда T = 273,15 К.
Действительно, запишем уравнение (2) для температуры T таяния льда и температуры кипения воды (T + 100):
Разделим второе уравнение на первое, получим:
Отсюда
На рисунке 2 схематически показаны шкала Цельсия и термодинамическая шкала.

Так как 1 К = 1 °С, то любое значение температуры Τ будет на 273,15 градуса выше соответствующей температуры t по Цельсию: Т = t + 273,15. Но изменение абсолютной температуры ΔΤ равно изменению температуры Δt по шкале Цельсия: Δt = ΔΤ.
Макроскопические и микроскопические тела.
Мы живем в макромире, и все предметы, которые нас окружают принято называть макроскопическими телами.
Да может быть ваша любимая кружка в масштабах вселенной кажется не такой уж и большой, чтоб носить приставку макро. Но относительно огромного числа атомов и молекул, из которых она состоит, это название вполне заслуженно.
Сами же атомы и молекулы, а также электроны, протоны, нейтроны принято называть микроскопическими телами или микроскопическими частицами.
Совокупности макроскопических тел или иногда отдельные макроскопические тела называют термодинамическими системами.
Так как эти системы состоят из огромного числа подвижных микроскопических частиц, они способны обмениваться веществом и энергией, как внутри самой системы, так и с окружающей средой.
Только представьте какие процессы происходят в Вашей кружке пока она остывает, дожидаясь Вас на кухне.
И здесь интересный момент. Для описания термодинамической системы не обязательно рассматривать поведение каждой отдельной ее молекулы. Это в принципе невозможно.
Состояние термодинамической системы прекрасно характеризуется набором макроскопических параметров, которые описывают систему в целом. Одним из таких параметров и является температура.